
文氨基观察武月
一生九死,是对创新药研发最好的概括。
根据 BIO 等组织发布的关于药物临床开发成功率的报告,其在统计完 9704 个药物的 1.27 万个临床开发项目后发现,2011 年至 2020 年十年间,药物开发项目从 1 期临床到获得 FDA 批准上市的成功率平均为 7.9%,所需要的时间平均为 10.5 年。
RNAi 药物的出现,打破了这一生九死的局面。
由于根据碱基互保配对原则,RNAi 药品开发类似编程,相比小分子或单抗等生物制剂开发成功率,高得不是一点半点。RNAi 领头羊 Alnylam 的临床转化成功率(1 期到 3 期累计)高达 64.3%,并且,目前全球获批的 5 款 RNAi 药物原研皆出自 Alnylam 之手。
RNAi 让我们处在了一个新的时代入口。当然,尽管其机制和成功率具有颠覆性,但更多选手还处在证明自己的阶段。
换句话说,Alnylam 超高的临床成功率背后,既离不开 RNAi 药物机制的本身优势,更离不开自身的奋斗。
正如其创始 CEO Maraganore 的总结,"找到解决方案的道路从来不是一条直线,达到目标的关键在于韧性、遵循科学的引导,以及培育追求创新的环境。"
01 超高临床转化率
"Alnilam"是猎户座腰带中明亮的中心恒星,数千年来一直被用于航海导航的"宇宙灯塔",这就是 Alnylam 公司名称的由来。
经过几十年的研发奋斗,Alnylam 终于让自己成为了 RNAi 领域的灯塔。
自 2002 年成立,在 2018 年之前,Alnylam 仍未上市第一款产品。而自 2018 年推出全球首款 siRNA 疗法 ONPATTRO 后,Alnylam 实现了几乎每年一款新药的获批上市。
至今,Alnylam 已获得了五种 RNAi 药物的批准,包括 patisiran、vutrisiran、givosiran、lumasiran(与诺华合作开发)和 inclisiran。
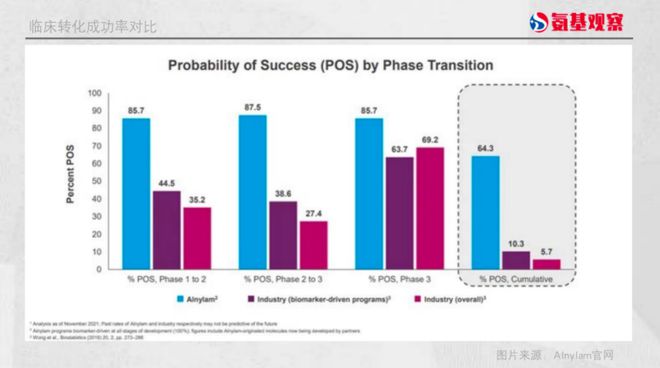
最重要的是,Alnylam 实现了极高的临床转化率。根据其披露的数据,在临床 1 期至 3 期阶段,其累计转化率达到 64.4%,而靶向药领域、医药行业整体的转化率分别只有 10.3% 和 5.7%。
也就是说,其相比整个行业 5.7% 的累计转化率,高出了 11 倍。
如下图所示,在不同临床阶段,Alnylam 都能实现 85% 以上的转化率。而行业内 2 期临床到 3 期临床的成功率最低,只有 27.4%,最终累计下来,转化率只有 5.7%。创新药研发一生九死,不是说说而已。
Alnylam 披露的这一组数据,与其他药物开发阶段转化成功率的研究也基本一致。2021 年,全球规模最大的生物技术行业组织之一 BIO、Informa Pharma Intelligence、QLS 联合发布了一份关于药物临床开发成功率的报告。
该报告对 2011 年至 2020 年,Biomedtracker 数据库中的 1779 个公司中,9704 个药物的 1.27 万个临床开发项目进行分析后发现,1 期临床到 2 期临床的成功率为 52.0%,2 期临床到 3 期临床的成功率最低为 28.9%,3 期临床到提交新药上市申请的成功率为 57.8%,递交 NDA/BLA 到获得 FDA 批准阶段的成功率则为 90.6%。
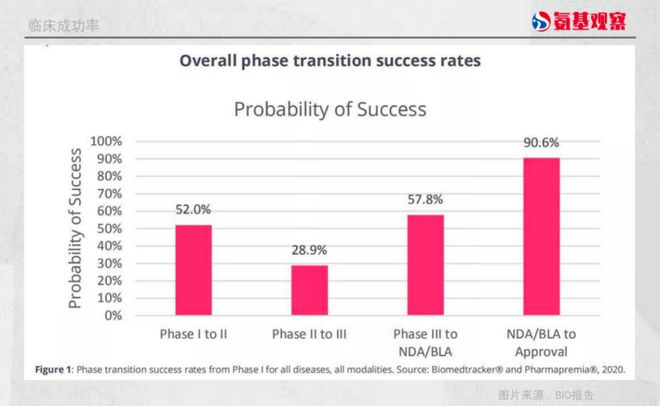
算下来,只有 7.9% 的新药能够从 1 期临床成功进展到最后的 FDA 批准上市阶段。
无论是 7.9%,还是 5.7%,对比下来,Alnylam 的临床转化率均足够高。
另外,在研发费用方面,2013 年至 2023 年,Alnylam 在 10 年间累计投入了 60.6 亿美元。作为对比,Novavax 和 BioNTech 过去 10 年的研发投入,与之最为接近,分别为 63 亿美元和 58 亿美元。
其中,BioNTech 与 Alnylam 使命更为接近,同样是在一个未知、未被验证的领域进行探索,但其成立至今已获批上市的仅有 mRNA 新冠疫苗。
不过,BioNTech 也是幸运的。靠新冠疫苗积累了巨额财富,在手现金高达 169 亿欧元,足够继续烧钱买买买和大开临床试验。
那么,Alnylam 是怎么做到 64.3% 的极高临床转化率呢?
02 死磕技术
这还要从 RNAi 药物的机制说起。
1998 年,来自美国的两位科学家将双链 RNA 导入线虫基因中,并发现双链 RNA 较单链 RNA 更能高效地特异性阻断相应基因的表达,他们称这种现象为 RNA 干扰(RNAi)。
RNAi 药物通过提供专门设计的小干扰 RNA(siRNA)来模拟这一过程,这些 siRNA 作为 RISC(RNA 诱导的沉默复合物)的一部分,与致病 mRNA 结合。一旦找到靶向 mRNA,就像一把分子剪刀一样,siRNA 与 RISC 一起切割"不需要的"基因,使其降解。
说得简单点,就是 siRNA 破坏了原本的基因表达过程,导致一些基因表达被阻断,自然也就没法继续发挥任何致病功能。
相比小分子和单抗,RNAi 药物可以靶向沉默基因组中的任何基因,具有强力和持久的作用机制,可以解决致病蛋白"不可成药"的难题;而在药物合成方面可能比筛选小分子或者生成生物制剂更为简单,其只需要锁定致病基因序列,通过与 mRNA 完成 Watson–Crick 碱基配对来实现其功能,无需契合蛋白质的复杂结构,因此研发成功率相对较高。
理论如此,但行业的发展不可能一帆风顺。RNAi 曾一度面临着稳定性差、递送效率低、安全性差等问题,其中,最为致命的是递送问题,siRNA 一旦送入体内,会被血液中的酶会迅速破坏,无法顺利递送至靶组织细胞发挥作用。
2003 年成立以来,Alnylam 就将超过 80% 的研发投入专注于 siRNA 的递送。采用了多管齐下的策略,包括偶联物、脂质纳米颗粒和生物材料等多种递送方式。
前后花费几年时间,评估几十种靶向一系列组织的外部来源的递送系统,但结果都令人失望。而后,Alnylam 通过与 Arbutus 达成合作,获得了后者的脂质纳米颗粒技术(LNP)的授权许可协议,Alnylam 使用该技术来传递其首个 RNAi 治疗药物 patisiran。
直到 2012 年,Alnylam 的"关键武器"GalNAc 偶联获得成功。Alnylam 深知开发技术是其核心壁垒,即使 GalNAc 成为了向肝脏递送寡核苷酸的主要技术,但公司不满足于仅仅解决 siRNA 的递送障碍,还不断对 siRNA 序列进行改造,催生了增强稳定化学技术(ESC)和随后出现的 ESC+ 技术,通过不同的 RNA 修饰持续提升 GalNac 的靶向性以及药效。
可以说,对于技术的坚持与突破,是 Alnylam 取得一切临床转化的基础。如果没有 Alnylam 对于递送技术的突破,或许 RNAi 领域还要在蹉跎几年。
03 产品导向
在 Alnylam 努力解决递送问题的十年中,外界对 RNAi 领域的热度快速激增,而后又以同样快的速度快速蒸发。
2010 年,罗氏、辉瑞、默沙东等大药企纷纷退出 RNAi 领域,RNAi 疗法走入了"至暗时代"。Alnylam 的股价也跌至了冰点,为了活下去,不得不大幅裁员。
在行业遭受重创时,Alnylam 决定将重心从平台转移到管线,因为要恢复对 RNAi 信心的唯一方法,就是拿出无懈可击的人体临床数据。
2011 年 1 月,Alnylam 启动了"Alnylam5x15"的战略计划,即在在 2015 年底前将 5 个 RNAi 治疗药物推进到临床阶段。
尽管研发团队反对,因为当时公司仅有一个肝靶向项目正在开发中,且尚未拿到人体临床数据,但在时任 CEO 的坚持下,Alnylam 仍是向外界抛出了这一口号。
2011 年秋天,Alnylam 研究的第一个重要结果出炉,在 ALN-TTR01 的一期临床中,患者 50-03 表现出明显的 TTR 沉默。这一结果首次证明了在人体中利用 RNAi 的能力,对于 Alnylam 来说,这是一个里程碑意义的时刻。同时这也预示着 RNAi 药物一系列显著临床转化成果的开始。
2015 年末,Alnylam 成功将 8 个项目推进临床研发。3 年后,其研发的 RNAi 药物 Onpattro 获得 FDA 批准,用于治疗 hATTR(遗传性转甲状腺素蛋白淀粉样变性神经病)。这也是全球首款 RNAi 药物。
截至目前,Alnylam 已经有 5 款获批 RNAi 药物。
除了前文提到的其对于递送技术研发的坚持与突破,更重要的是,Alnylam 的产品导向。
所谓产品导向,Alnylam 曾在其财报中进行过解释。简单来说,Alnylam 开发的重点是那些具有高度未满足需求、具有经遗传学验证的靶点、具有在 1 期临床研究中进行临床活动评估的早期生物标志物的临床指征,以及明确的药物开发、监管批准、患者获取和商业化途径。
事实上,目前 Alnylam 所有的获批项目都基于遗传学验证过的靶点。典型如 PCSK9 靶点。2003 年,研究人员发现在 PCSK9 基因中出现的突变会导致 PCSK9 蛋白的表达升高,并且推动 LDL-C 水平的上升,导致家族性高胆固醇血症的发生。
PCSK9 成为第三个被发现的与胆固醇代谢有关的基因。之后不久,另一个研究团队报告在少数人中存在自然发生的抑制 PCSK9 表达的基因突变。这些人具有非常低的 LDL-C,并且心血管疾病发病率显著下降,没有显示出其它的不良作用。
除了经过人类遗传学验证,PCSK9 靶点之所以吸引人,还在于 PCSK9 蛋白主要在肝脏表达,这让其成为一个在正确组织里的高度验证靶点。正对 Alnylam 的技术路线,其与诺华合作研发的长效降脂针 Leqvio,通过基因沉默的方式,直接阻止肝脏产生 PCSK9 蛋白,以达到持久的治疗效果。2023 年 Leqvio 全年销售额 3.55 亿美元,同比增长 2.17 倍。
更具确定性,加上 RNAi 机制所独有的高成功率,使得其临床转化率极高。至今这些关键特征仍然在 Alnylam 的开发中扮演着重要作用。
04 偶然还是必然
尽管 Alnylam 认为,5x15 是其从平台公司向产品公司转型的基础。但本质上,RNAi 药物研发正是平台技术转化的成果。
换句话说,RNAi 药物呈现出平台化的特点。就像 ADC、mRNA 技术平台那样,经过验证后,能够源源不断孵化新的管线。这也是 Alnylam 临床转化率高的核心原因之一。
正如行业老二 Arrowhead 公司 CEO 所言,只做一款药物是在赌博,要运用 RNAi 平台优势,多做药物,争取突破。
这也就很好解释了,为什么大多数初创 biotech 都是3-5 个在研项目,而不管 Alnylam、IONIS 还是 Arrowhead,管线都可以铺满屏幕,几乎都是 10 个起步。

6 月 24 日,Alnylam 披露其 RNAi 疗法 Amuvttra(vutrisiran)用于治疗 ATTR-CM 患者的Ⅲ期临床结果。在所有人群中,vutrisiran 在主要终点和所有次要终点上均具有统计学显著性。其计划在年底前,使用优先审评券向 FDA 递交补充新药申请。
一旦成功扩围至 ATTR-CM 领域,意味着 Alnylam 将进入一片广阔的蓝海。数据显示,全球有 20-30 万人患有 ATTR-CM,而获批的药物仅辉瑞的小分子稳定剂 Tafamidis,去年销售额超过 33 亿美元。
更重要的是,公司可以该适应症获批带来的真金白银,继续源源不断地扩充管线,包括心血管疾病、神经性疾病、自免疾病甚至癌症等领域。凭借 RNAi 相对于小分子和抗体类药物的优势,包括疗效、给药间隔、安全性,再加上 RNAi 药物非常高的临床成功性,Alnylam 将进入一个全新的局面。
Alnylam 今日成就达成背后,有着不确定的偶然甚至运气,毕竟,RNAi 机制是通用的,但其他 RNAi 玩家尚处于证明自己的阶段。但也总是偶然背后有必然。
对于 Alnylam 来说,这种必然既在于前文所讲的技术以及产品导向,也在于其对于一些质朴商业原则的坚持与实践。
比如对于人才的重视与尊重。创始团队包括诺贝尔生物医学奖获得者 Phillip Sharp,生物物理化学家 Paul Schimmel、分子生物学家 David Bartel、生物化学家 Thomas Tuschl 和分子生物学家 Phillip Zamore,这样的人才配置,对于一家技术型公司的意义不言而喻。
与此同时,Alnylam 在公司层面非常重视科学家的自主创新,建立了"20% 时间规则",即使在公司运营成本逐渐增加的情况下,也要为研究团队提供一些自由度,鼓励科学家用 20% 的时间去实现自己的想法。
事实上,公司的几项重要突破,均是在这种鼓励创新的氛围下产生的。包括最为核心的 GalNAc 偶联技术,以及靶向中枢神经系统的 C16 偶联 siRNA 递送技术等。
很多人都创新当成了一个结果,但事实上,创新是一个过程。理解了这一点,你就会理解为什么一些企业难以激发创新活力。
除此之外,在 2010 年行业最低谷时,Alnylam 仍决定坚持投入。最艰难的一次是在 2016 年,一项关键临床试验出现了问题,不得不停止研究。
消息公告后,Alnylam 市值当天蒸发 70 亿美元,投资者担心更广泛的平台安全问题,波及整个产品管线,甚至整个 RNAi 领域。
这对 Alnylam 来说是非常大的考验,好在公司顶住了压力,这才有了 2018 年第一款 RNAi 药物的获批,以及 RNAi 疗法的实际验证。
无论是对人才的重视,鼓励创新的文化,还是在逆境中的坚守,这些原则对创新药企来说并不陌生,但真正能将之贯彻始终的,寥寥无几。这或许是 Alnylam 为行业带来的最大的启示之处。






