闻乐发自凹非寺
量子位 | 公众号 QbitAI
借助 AI,新型蛋白质合成周期大幅降低!
这些蛋白质还能有效抵抗像大肠杆菌这类抗生素耐药细菌。

一项来自澳大利亚的研究发现,像大肠杆菌这类致病菌会通过ChuA 蛋白(细菌中的一种外膜蛋白)从宿主血红蛋白中“偷”血红素获取生长所需的
研究人员借助 AI 工具,成功设计出能与 ChuA 结合的蛋白质,这些蛋白质就像“门卫”一样,阻止 ChuA 与血红蛋白接触,从而抑制细菌生长。
并且,部分 AI 设计的蛋白质在低纳摩尔浓度下就能发挥作用。
该研究现已发表于 Nature Communications

这项研究由 Gavin Knott 教授和 Rhys Grinter 博士共同领衔,他们研发出的 AI 蛋白质设计平台是澳大利亚首个模拟诺奖得主 David Baker工作的平台,采用端到端的方式创建了多种蛋白质。
并且,平台使用的是全球科学家均可使用的 AI 驱动蛋白质设计工具,能够让更多科研人员能参与其中,推动该领域发展。
研究原理:用算法打造抗菌 “分子锁”
对于包括大肠杆菌和志贺氏菌在内的大多数细菌,铁是其生长和导致感染所必需的关键营养物质
在感染过程中,宿主(如人体)会启动一种被称为“营养免疫”的先天免疫机制,主动隔离游离铁,使其成为细菌生长的限制性因素。
为了应对这种铁限制,细菌演化出了多种策略来获取铁,主要包括两种:
一是分泌被称为铁载体的化合物来络合铁,然后将其重新导入细胞;
二是直接从宿主含铁蛋白质中提取血红素,或直接吸收游离血红素。
志贺氏菌和致病性大肠杆菌就是利用一种名为 ChuA 的外膜转运蛋白,从宿主血红蛋白中“偷”血红素

基于此,研究团队聚焦于 AI 驱动的蛋白质设计与细菌致病机制研究,开展了从机制解析到 AI 设计的闭环工作。
研究团队先通过冷冻电镜、X射线晶体学等多种技术,弄清楚了 ChuA“偷”血红素的机制。
他们发现,ChuA 通过其胞外环 7 和 8 与血红蛋白二聚体相互作用,ChuA 主要通过特定的组氨酸残基(His-420 和 His-86)结合血红素,且与血红蛋白的结合具有动态性。
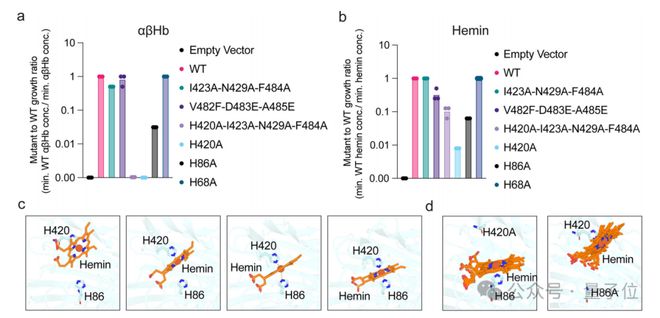
基于这个发现,研究人员提出了一种创新性的抗感染策略:通过阻断细菌获取必需营养素来抑制其生长
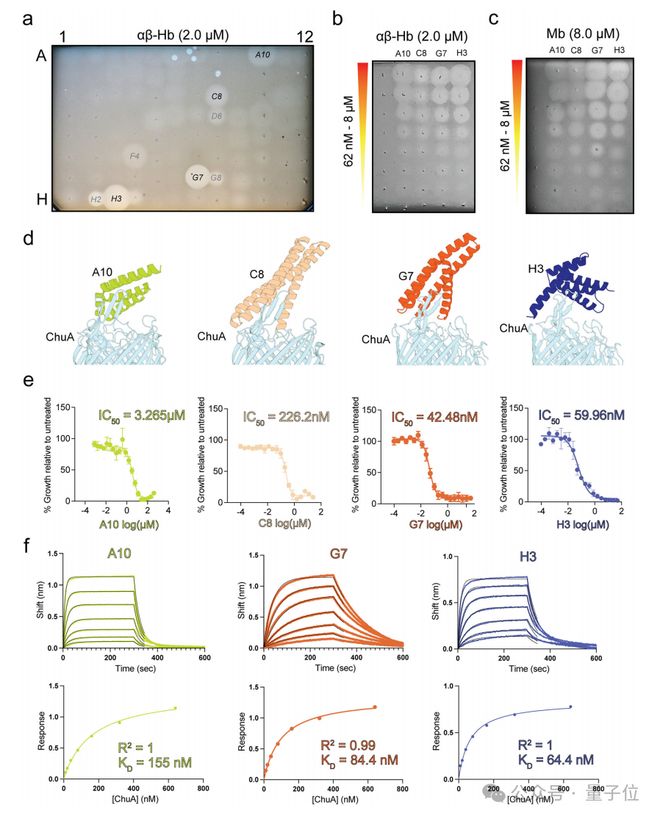
他们先利用RFdiffusionProteinMPNN等 AI 算法,从头设计了一系列能够特异性结合 ChuA 的蛋白质。
这种基于深度学习的设计流程,在极短时间内就完成了传统方法需要数月甚至数年的蛋白质设计工作。
结构分析显示,AI 设计的蛋白质与 ChuA 的结合结构和计算预测高度吻合,C8的晶体结构与 AI 模型的均方根偏差仅为 0.6Å,充分证明了 AI 算法在蛋白质设计中的精准性。
这些蛋白质就像一把“分子锁”,能够精确阻断血红蛋白与 ChuA 胞外环 7 和 8 的结合,从而阻止血红素的提取。
然后,团队对这些抑制剂进行了筛选,找出其中最高效的部分蛋白质。
研究团队仅筛选了96 个AI 设计的蛋白质,就从中发现了多个能在低纳摩尔浓度下抑制大肠杆菌生长的高效抑制剂。
其中,抑制剂G7的 IC50 值*(半最大抑制浓度,衡量抑制剂效力的关键指标)低至 42.5nM,展现出媲美传统抗菌药物的效力。
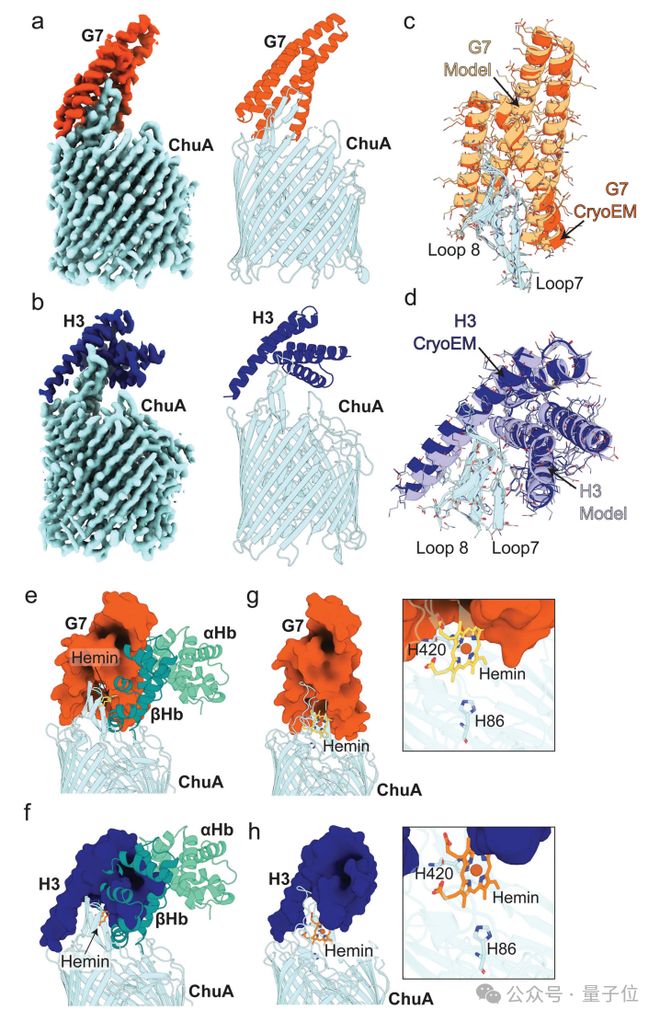
这种“设计-筛选”的高效模式,颠覆了传统蛋白质药物研发的试错模式,为抗菌药物的快速迭代提供了可能。
研究还强调了这些结合蛋白的卓越特异性:它们只抑制 ChuA 从血红蛋白中提取血红素,而对游离血红素的转运没有影响
更重要的是,它们不结合其他无关的转运蛋白
该研究的突破性在于,它开创了一种“非抗生素”的抗菌新范式。
不同于传统抗生素直接杀灭细菌,AI 设计的蛋白质通过阻断细菌获取必需营养物质来抑制其生长。
这种“饿死细菌”的策略,有望大幅降低细菌产生耐药性的风险,为解决全球抗生素耐药危机提供了全新思路。
负责该项目的 Gavin Knott 教授是 Snow 医学(推动免疫学研究的重要力量)研究员,他与墨尔本大学 Bio21 研究所和莫纳什生物医学发现研究所共同领导了新的 AI 蛋白质设计项目。

实际上,AI 在推进蛋白质合成方向取得诸多核心进展,涵盖模型开发、技术应用及产业成果等多个层面。
AI 推进蛋白质合成方向上的核心进展
从 2018 年起,DeepMind 推出的 AlphaFold 率先在蛋白质结构预测领域实现里程碑式突破,尤其是 2020 年发布的 AlphaFold2,精度接近实验水平,解决了持续数十年的“蛋白质折叠”难题。

随后,华盛顿大学推出的 RoseTTAFold(2021)和 Meta 的 ESMFold(2022)进一步推动了结构预测工具的普及与加速。
此外,基于 Transformer 和扩散模型的生成式蛋白质模型(如 ProtGPT2、ProGen)也相继问世,让 AI 不仅能预测蛋白质结构,还具备了设计新蛋白质的能力,进入了“AI 造蛋白”时代。
自 2021 年起,科研机构和企业开始构建“设计—建造—测试—学习(DBTL)”闭环系统,将 AI 预测结果与自动化实验平台深度集成,从而大幅提升蛋白质合成的效率与规模。
AI 模型如今不仅能预测结构,还能综合考虑蛋白质的功能、稳定性与结合能力,辅助实现功能定向优化。
长期来看,AI 驱动的精准蛋白质设计可能重塑抗菌药物研发模式,推动“按需定制”治疗方案的发展。
论文链接:https://www.nature.com/articles/s41467-025-60612-9
参考链接:https://www.sciencedaily.com/releases/2025/07/250710113152.htm
— 完 —






