
复合凝聚,是液-液相分离的一种形式,在生命起源中扮演着独特角色,并具有重要的生物学意义和工程学意义,在新型功能材料的开发中具有广阔前景。
基于液-液相分离的细胞内复合凝聚形成的细胞间室称为生物分子凝聚体,它们构成了细胞中的无膜细胞器。
这些无膜细胞器与有膜细胞器可以发生相互作用,从而能够实现细胞内的多种生理功能。
此外,细胞外的复合凝聚在多种生物过程中同样扮演着重要的角色。例如,海洋生物通过分泌的粘合蛋白分子发生液-液相分离,来增强水下粘合性能。
而两种带相反电荷的聚电解质分子可以通过熵驱动的液-液相分离,形成复合凝聚物,其具备水溶性、半渗透性和高电荷密度,被广泛用于基因、药物输送、负载催化、纳米反应器和复合膜材料等领域。
传统聚电解质形成的复合凝聚物,通过宏观相分离复合而成。其分散度高、稳定性较差、尺寸通常较大、结构形成也较为复杂。
为了解决上述问题,吉林大学陈学思院士/孙静教授团队将目光投向与蛋白质有相似骨架结构的拟肽高分子。
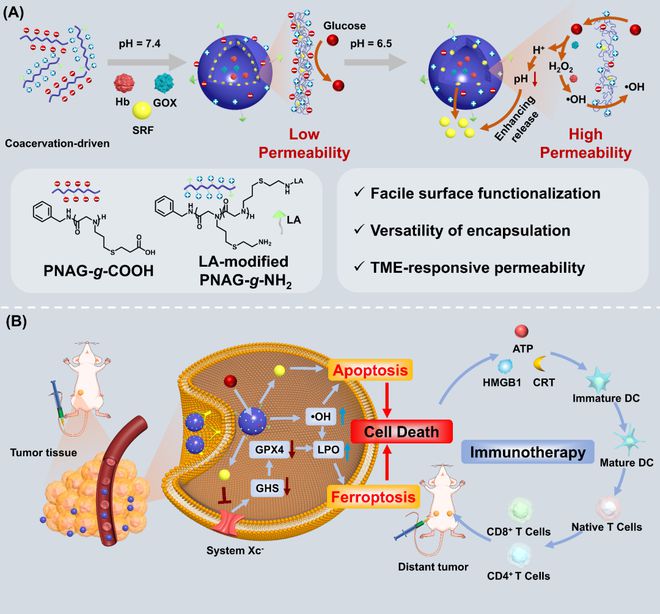
他们采用含有两种相反电荷的均聚拟肽高分子,通过复合凝聚作用,构筑了具有空心囊泡结构的纳米复合聚电解质材料。
课题组表示在生物分子凝聚体的启发之下,他们发现基于复合凝聚作用的合成聚电解质仿生纳米载体是一种理想的多肽蛋白类药物载体材料。
此前,人们常常通过构建由两种或多种性质不同的聚合物链段组成的嵌段共聚物来实现微相分离,以便有效地控制聚电解质复合物的尺寸和稳定性。
该团队另辟蹊径,瞄准了拟肽聚合物。其中,聚类肽是一类新兴的生物高分子材料,其主链酰胺键氮原子上的氢被侧链基团取代,因此聚类肽主链柔性较好,可以很好的调控分子内/分子间相互作用。
基于此,课题组采用活性开环聚合的方法,合成了两种结构非常简单的含有相反电荷的均聚类肽高分子。
借助聚类肽独特的链结构,构筑了与传统聚电解质凝聚液滴结构完全不同的空心囊泡纳米结构。
鉴于相似的化学结构,他们还采用这种简单方便的策略制备了聚噁唑啉电解质纳米囊泡。
(来源:Advanced Materials)
相比传统的聚电解质凝聚液滴,这种囊泡展现出高稳定性、窄分布性、可修饰性、防污性能、可调的膜通透性、优良的生物相容性以及肿瘤微环境响应性等,是一种新型高效的仿生纳米载体材料。
日前,相关论文以《凝聚驱动的半透性纳米反应器用于酶级联介导的高效癌症联合疗法》(Coacervation-Driven Semipermeable Nanoreactors for Enzymatic Cascade-Mediated Cancer Combination Therapy with Enhanced Efficacy)为题发在 Advanced Materials[1],博士生林敏是第一作者,陈学思院士和孙静教授担任共同通讯。

图相关论文(来源:Advanced Materials)
这种基于复合凝聚作用的仿生纳米载体材料,涉及到物理、化学、生物、材料科学等多个学科。
随着后续研究的不断深入,其将有着更为广泛的应用前景,不仅仅局限于材料科学和医学领域,也将在能源、环境等领域实现潜在价值。
研究人员表示,尽管这种纳米材料制备简单方便,且应用前景广阔,但其大规模应用仍面临一些挑战,如材料成本、稳定性等问题。
因此,未来还需进一步优化材料结构性能,确保其能够发挥重要的作用。所以,他们将进一步完善当前的抗肿瘤载体的工作,并将积极拓展其他的应用领域。
参考资料:
1. Lin, M., Lv, X., Wang, H., Shu, L., Wang, H., Zhang, G., ... & Chen, X. (2024). Coacervation‐Driven Semipermeable Nanoreactors for Enzymatic Cascade‐Mediated Cancer Combination Therapy with Enhanced Efficacy. Advanced Materials, 2407378.
2. Shu, L., Gong, Y., Lin, M., Sun, J., Chen, X. (2024) Advanced coacervation-driven nanoscale polymeric assemblies for biomedical applications, Applied Physics Review, 11, 021333.
运营/排版:何晨龙






