
在人体复杂的免疫系统中,存在着一种微妙的平衡:既能有效清除“异己”,又能避免误伤“友军”。然而,这种平衡有时会被“狡猾”的肿瘤细胞所利用,逃脱免疫系统的监视。
CD47-SIRPα免疫检查点就是人体内的“哨卡”之一,CD47 和 SIRPα的结合能传递“别吃我”的信号,保护健康细胞不被吞噬。不幸的是,肿瘤细胞也学会了这一机制,“伪装”成正常细胞,从而躲避被“吃掉”的命运。CD47 一度被视作新一代免疫疗法的热门靶点,但近年来相关临床试验却总是频频折戟。
近日,中国科学院微生物研究所/生物物理研究所朱明昭课题组与清华大学傅阳心教授团队发现 CD47-SIRPα靶向肿瘤免疫治疗新机制,该研究成果于北京时间 7 月 10 日发表在《自然-通讯》杂志。
体内的“伪装”游戏
如果将人体比作城池,免疫系统就是抵御外敌的城墙。其中免疫检查点就像一个个“哨卡”,巨噬细胞则好似巡逻的“哨兵”,能吞噬病原微生物或异常的肿瘤细胞,将其分解后把信息传递给T细胞,也就是免疫系统的“主力军”,再由T细胞消灭被感染的细胞及肿瘤细胞等。
如何才能躲过巨噬细胞的识别和追杀?一些“狡猾”的肿瘤细胞选择披上“画皮”,蒙混过关。
巨噬细胞表面存在一种受体——SIRPα(信号调节蛋白α),当其与 CD47(整合素相关蛋白)相结合时,能传递“别吃我”的信号,让巨噬细胞分辨敌友,避免误伤。一般来说,CD47-SIRPα的结合是为了保护健康细胞免受巨噬细胞吞噬。然而,现在肿瘤细胞也发现了这个“漏洞”,开始在自身表面过量表达 CD47,如此一来,当其遇到巨噬细胞时,就会通过 CD47 与 SIRPα的结合,穿上“隐身衣”,向巨噬细胞发出虚假的“别吃我”信号,进而逃脱免疫系统的监视,在人体内肆意生长,成为“隐形的敌人”。
鉴于 CD47-SIRPα检验点在肿瘤免疫逃逸中的关键作用,科学家们一直在努力寻找针对这一检验点的治疗方法,例如通过不同途径阻断 CD47-SIRPα检验点,恢复免疫系统对肿瘤细胞的识别和攻击能力。
然而,CD47 靶向肿瘤免疫治疗的临床试验进展异常坎坷。一方面是安全性问题,由于 CD47 广泛存在于正常细胞尤其是红细胞表面,如果阻断这一通路往往会“误伤”红细胞,造成贫血等不良反应;另一方面是有效性挑战,近年来由于临床效果没有显著改善,并未达到预期指标,许多国际知名生物医药公司相继终止了相关临床试验,如吉利德、ALX Oncology 等。
眼看 CD47 靶向阻断剂的研发接连陷入困境,中国科学院微生物研究所/生物物理研究所研究员朱明昭想一探究竟。
换个思路解难题
“关于免疫治疗方式的效果好坏,大家通常首先想到的是肿瘤免疫微环境中各种免疫细胞发挥了调控作用。”朱明昭告诉《中国科学报》,“但这些免疫细胞的上游调控因素是什么?这方面的研究就少多了。”于是,朱明昭团队决定转换思路、追本溯源,将目光投向肿瘤免疫微环境的最上游塑造者——肿瘤细胞。
“实际上,肿瘤细胞具有非常强的异质性,不光是个体之间存在,肿瘤内不同细胞间也存在异质性。肿瘤细胞不同的功能状态会不会影响免疫治疗的效果,我觉得这是个非常值得研究的问题。”朱明昭告诉记者。
此前有研究发现,当阻断 CD47 和 SIRPα间的相互作用时,IFN-I(Ⅰ型干扰素)作为一类具有抗病毒和抗肿瘤活性的细胞因子会激活抗肿瘤T细胞的免疫应答。但在此过程中,肿瘤细胞发挥了怎样的作用?肿瘤细胞本身的状态如何影响 CD47 靶向治疗的效果?科学家们还不得而知。
朱明昭团队决定从这里入手,他们利用小鼠肿瘤模型进行转录组分析并验证后发现,CD47 阻断治疗后,肿瘤细胞对 IFN-I 信号的响应性决定了治疗的效果。但肿瘤细胞哪些下游信号通路响应了 IFN-I,又怎样促进了抗肿瘤的免疫应答?
为解开这个迷题,朱明昭团队用了四五年的时间,结合肿瘤细胞的其他组学特征,对多种可能性逐一排除验证,最终发现 IFN-I 能诱导肿瘤细胞的代谢重编程和分泌性自噬,产生并释放 ATP(三磷酸腺苷)。ATP 则激活了树突状细胞,这是人体免疫系统的“联络员”,一旦发现病原入侵或肿瘤抗原,就会迅速提取其关键特征,并“报告”给T细胞,也正是树突状细胞的“助攻”,促进了肿瘤特异性T细胞的免疫应答。
“基于这样的新机制,结合肿瘤免疫微环境的特点,我们还进一步设计了联合治疗新方案,大大提高了 CD47 靶向治疗的效果。”朱明昭告诉记者。
期待临床验证
对朱明昭而言,从免疫细胞到肿瘤细胞,研究思路的转变并非一蹴而就。
“我们团队长期以来的主要研究方向其实是淋巴组织微环境,包括胸腺和淋巴结等,研究淋巴组织的微环境信号如何影响适应性免疫细胞,特别是T细胞的发育、稳态和应答。但近几年,我们也积极探索非淋巴组织微环境对T细胞功能的影响。这不是简单地从一种组织微环境向另一种组织微环境的转变,更是在T细胞的发育、稳态和应答之后,进一步延伸探讨T细胞的功能。”朱明昭向记者介绍,而肿瘤则是T细胞发挥功能的重要场所,且肿瘤微环境足够复杂,充满挑战。
同时,朱明昭的博士后导师——清华大学医学院教授傅阳心是肿瘤免疫治疗领域的著名科学家,长期耳濡目染中,朱明昭对肿瘤微环境这一研究领域也并不陌生。
因此,在朱明昭看来,研究思路的转变不过是在已有研究基础上自然延伸、水到渠成的结果。
“大概在七八年前,我决定利用肿瘤免疫治疗的模型,研究肿瘤微环境是如何调控抗肿瘤T细胞免疫应答和功能的。”朱明昭告诉记者,在本研究中,傅阳心团队在研究思路的讨论,肿瘤模型的建立和重要试剂的提供等方面也提供了重要帮助。
自从确定了从肿瘤细胞追本溯源的基本思路后,朱明昭团队经过不懈探索,终于发现 CD47-SIRPα检验点阻断剂通过I型干扰素信号调控肿瘤细胞代谢重编程促进抗肿瘤免疫应答的新机制,提出并验证了联合治疗新方案。
在当前 CD47 靶向药物研发频频失败的困境下,这一成果有望为 CD47 靶向药物的研发和临床试验设计提供新的理论指导。
然而,在朱明昭眼中,本研究也还存在很多遗憾,“我们研究主要是基于小鼠肿瘤模型展开,目前仍缺少临床数据的支持。我们一直在努力寻找 CD47 靶向临床试验的研究队伍,希望能验证我们的新发现。但由于当时国内这方面的临床试验团队数量很少,最终还是没能进行临床验证。”
面向未来,朱明昭满怀期待,“希望今后能够有机会与临床团队合作开展这些研究,也希望有机会与相关研发企业合作,推动 CD47 靶向新型免疫治疗策略的研发。”(来源:中国科学报赵宇彤)
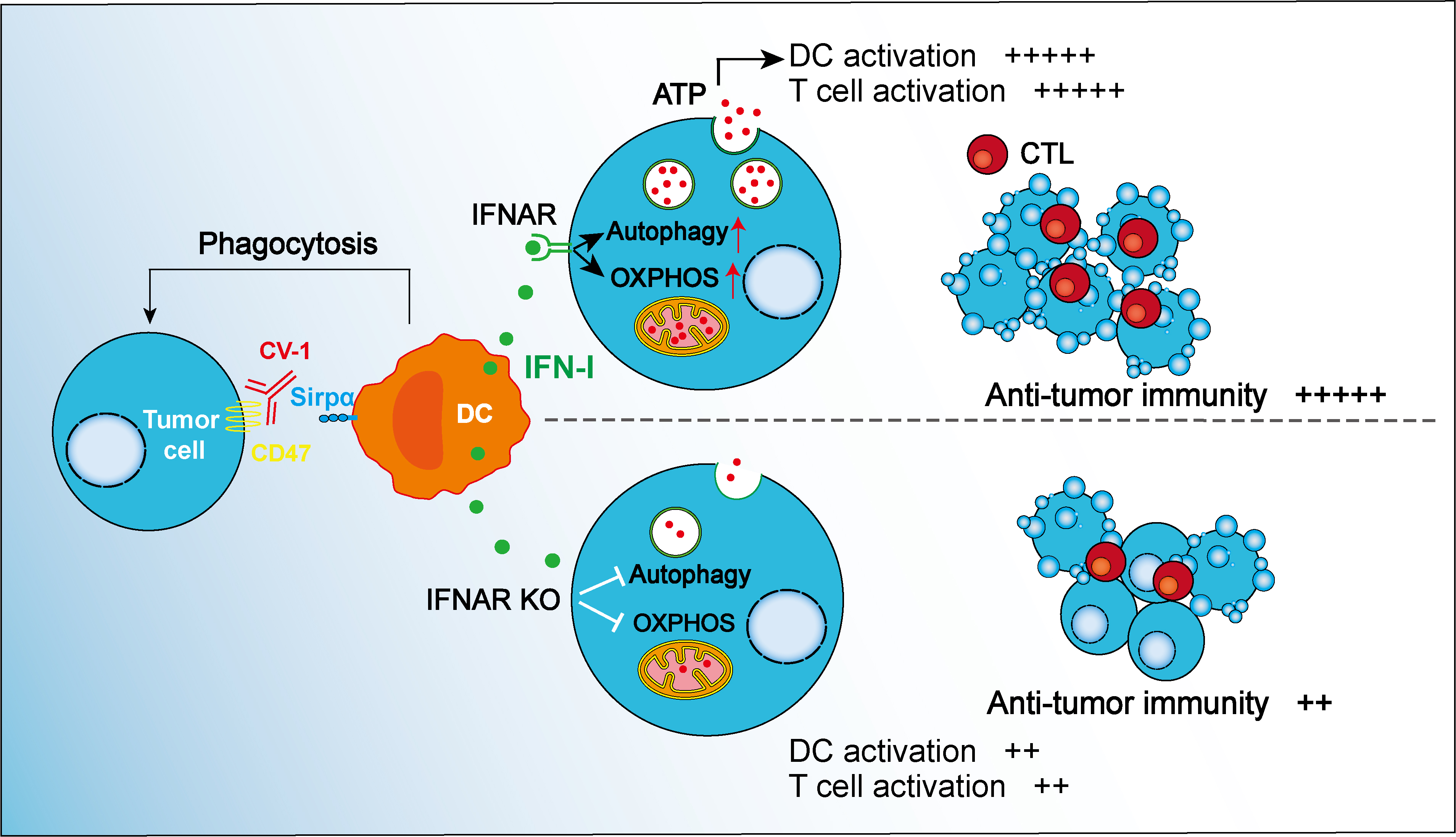
CD47 靶向肿瘤免疫治疗的新机制受访者供图






