
2022 年 12 月下旬,美国总统乔·拜登签署法案:新药不需要在动物上进行试验也能获得美国 FDA 的批准。该法律取代了 1938 年的规定(潜在药物必须在动物身上进行安全性和有效性测试),允许 FDA 在动物或非动物试验后,将药物或生物大分子(如抗体)推广到人体试验。
该立法主要推动者、人道经济中心研究和监管政策主任 Tamara Drake 的团队和非营利组织“动物健康行动”以及其他推动变革的组织认为,在为药物进行人体试验的过程中,FDA 应该更多地依赖计算机建模、“器官芯片”和其他在过去 10 到 15 年里发展起来的非动物方法。其中,非动物方法还包括基于细胞的测定、类器官、迷你模型等。
作为真实器官的缩影,类器官是一种利用人体干细胞或从病人身上提取的肿瘤组织,在特定的 3D 体外微环境中培养而成,高度模拟人体器官特征的小型化体外器官模型。其最早的研究可追溯到 1907 年,但飞速发展是在近 10 年。
2010 年前后,从早期的器官芯片雏形、肺、肠、肝等单器官芯片再到串联多个器官的多器官芯片,科研人员逐渐开发出功能更为完整和复杂、仿真度更高的模型;2011 年,美国政府率先启动人体微生理系统(器官芯片)国家战略,将器官芯片从战略层面制定支持计划;随后欧洲国家也相继加大对器官芯片和类器官的投入;2021 年,中国也开始从基础研究和监管层面系统性推动类器官和器官芯片技术的发展应用。
近日,类器官领域又有突破。来自辛辛那提儿童医院的研究人员表示,他们已经将人体肠道组织的微小三维球移植到小鼠体内。几周后,这些被称为类器官的球体形成了人体免疫系统的关键特征。该模型可用于模拟人体肠道系统,而无需在病人身上进行试验。
相关研究以题为“In vivo development of immune tissue in human intestinal organoids transplanted into humanized mice”发表于 Nature Biotechnology。且研究人员表示,这是第一个包含功能性免疫系统的任何类型(心脏、肝脏、胃等)的体内类器官。
这项研究由辛辛那提儿童医院儿科外科医生 Michael Helmrath 和第一作者 Carine Bouffi 博士领导。前者在临床上重点关注患有肠道疾病和肥胖症的患者;后者现在是勃林格殷格翰的高级科学家。此外,这项研究的合作者还包括来自约翰霍普金斯大学医学院、密歇根大学和法国南特大学的研究人员,共 5 个机构的 20 多名研究人员参与了此次研究。

▲图 Michael Helmrath(来源:官网)
这并不是辛辛那提儿童医院的研究人员第一次在类器官方面取得如此突破。2010 年,该机构就成为世界上第一个创建肠道类器官的机构,同时也是首个利用诱导多能干细胞(iPSC)创建功能性肠道类器官的团队。且该中心取得过多个里程碑,包括创建出世界上第一个食道和胃类器官。

含 20 种人类免疫细胞
肠道是人体重要的消化器官。当肠道出现故障,或在发育过程中无法正常形成时,就会发生多种胃肠道疾病,如炎症性肠病、嗜酸细胞性食管炎和乳糜泻等。许多从轻微到致命的传染病也始于肠道。
类器官常被用作药物测试的人类化身。由于它们包含人体细胞并显示出与真实器官相同的一些结构和功能,因此一些研究人员认为它们是比实验室动物更好的替代品。
在这项研究中,为了培养这种类器官,科学家们从 iPSC 开始,这些干细胞是由从血液或皮肤中提取的成熟人体细胞产生。通过给干细胞“喂食”特定的分子混合物,在培养皿中生长 28 天后,形成直径达几毫米的球体。
接下来,团队将这些球体移植到经过基因工程抑制自身免疫系统的“人源化”小鼠体内,方法是将他们置于小鼠肾脏周围的膜下,实际并未连接到动物的消化道。为了刺激类器官产生人类免疫细胞,他们之前给老鼠注射了人类脐带血。
在第 12、16 和 20 周时,实验室团队收集了类器官以分析它们所含的细胞类型。他们发现类器官包含多种类型的人类免疫细胞,这些细胞是从人源化小鼠迁移而来的,包括 CD45+ 细胞和称为肠道相关淋巴组织 (GALT) 结构的重要细胞结构。
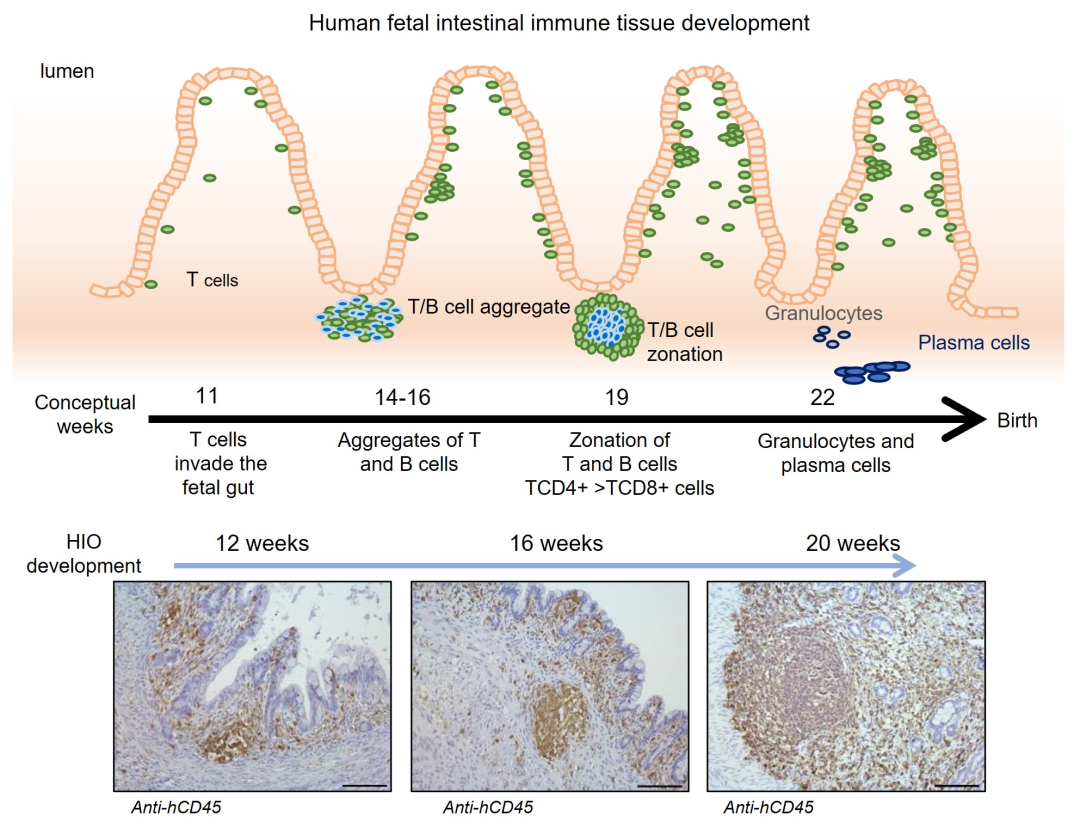
▲图肠道类器官反映人体免疫系统在肠道中的发育方式
20 周后,每个类器官都长到豌豆大小,直径达到约 1 厘米,并包含大约 20 种人类免疫细胞。“这与我们在人类肠道中看到的种群非常相似。”Helmrath 表示。此外,类器官还形成了人类淋巴滤泡或淋巴结,这是肠道中的重要结构,通过维持健康细菌的水平来阻止病原体进入。
为了测试免疫细胞是否真正起作用。团队将类器官暴露于大肠杆菌中,结果类器官产生了功能性 M 细胞,M 细胞是在肠道内壁发现的免疫信号细胞,通常会受到感染和炎症的刺激。
“开始这个项目时,并不确定在人源化小鼠体内植入肠道类器官会有效,因为以前从未做过”,Carine Bouffi 表示,“得到第一个结果时,我们看到了类器官中免疫细胞的浸润,我认为宿主小鼠正在排斥类器官。但经过进一步分析,我们发现这些免疫细胞实际上是有组织的,并在后来发展成可与人体肠道媲美的免疫组织。”
德克萨斯理工大学健康科学中心胃肠病学家 Matthew Grisham 表示,这些发现令人兴奋,因为这些结构具有“与发育中的人类肠道非常相似的人体免疫细胞组成”。他表示肠道类器官模型将帮助科研人员研究导致肠道感染、炎症和食物过敏的机制。他并未参与本次试验。

为肠道疾病治疗提供新方式
在药物开发早期阶段,类器官正在逐步取代传统模型。“国际类器官鼻祖”Hans Clevers 曾在接受生辉的采访中表示,“我们做了十几年的类器官研究,发现很多患者的肿瘤样本都能培养成为长期培养的类器官,并且患者来源的类器官表型特征与原发肿瘤高度一致,也保留着很强的肿瘤异质性。相比于目前肿瘤药物研发中常用的 2D 细胞或 PDX 模型,类器官模型的肿瘤异质性或许更能接近患者的真实情况,为高通量筛选新的治疗靶点和药物提供了可能。”2009 年,他的实验室团队使用单个 LGR5 + 肠干细胞在体外自组织成具有肠隐窝 - 绒毛结构的肠类器官,这是首个体外自组织的微型器官。
迄今为止,研究人员已经能够制造出类似于大脑、肾脏、肺、肠、胃和肝脏的类器官。如肾脏类器官已可模拟多种疾病,包括多囊肾病、囊性纤维化、肾细胞癌和病毒感染等;脑癌、乳腺癌、宫颈癌、结直肠癌、胃癌、头颈癌、肾癌、肝癌、卵巢癌和胰腺癌的患者来源类器官 (PDO) 的生物样本库也已大规模开展,以根据临床异质性促进免疫疗法和精准医疗。
(来源:Technology Networks)
据 Helmrath 表示,经过改进后的类器官的第一个应用可能涉及将他们用作测试平台,以更多地了解影响消化道的许多免疫介导疾病。与动物模型不同,类器官可以培养以更准确地反映常见疾病状态的遗传条件,甚至可以充当模仿特定患者器官组织的“化身”。且根据 FDA 的数据显示,约 92% 在动物试验中证明了安全、有效的药物,却在临床试验中失败。
近期,团队计划从患者自己的细胞中制造类器官,以测试可能的个体化疗法。用于治疗先天性遗传缺陷影响消化系统的患者,或者因癌症或炎症性肠病而丧失肠道功能的患者。
从长远来看,团队希望用更大的动物宿主复制他们在小鼠身上的成功,这些动物宿主可以产生更大量的人体类器官组织。如果成功,Helmrath 实验室创建的类器官组织最终可能会成为活体贴片,帮助受损器官在人们需要全器官移植之前实现自我修复。
参考资料:
1. https://www.nature.com/articles/s41587-022-01558-x
3. https://www.cardiometabolichealth.org/article/new-legislation-moves-away-from-animal-testing/






