新智元报道
编辑:David 昕朋
新的一年,XBB 毒株来势汹涌。面对不断突变的新冠病毒,武汉大学研制的这款广谱疫苗,可能会终结新冠?
新冠凶猛。
新防控政策下,感冒药、退烧药、腹泻药、血氧仪、制氧机等先后成为紧俏商品,辉瑞特效药 Paxlovid 更是一度一盒难求。
目前的新冠疫苗很难防住变异后的毒株,尤其是奥密克戎。
新冠病毒 SARS-CoV-2 持续累积突变,免疫逃逸能力越来越强,导致人们在接种疫苗后仍会出现突破性感染。如何提前预测病毒的进化轨迹,成为研究人员在下一代疫苗的设计中需要攻克的难题。
武汉大学病毒学国家重点实验室蓝柯教授和徐可教授团队在研究总结新冠病毒的进化轨迹后,设计出了一种新冠广谱疫苗,或可抵御未来变异株对人群的侵害。
1 月 4 日,该研究论文在知名期刊《科学·转化医学》(Science Translational Medicine)上发表。

论文链接:https://www.science.org/doi/10.1126/scitranslmed.abo3332
五大突变全覆盖,从追赶病毒到跑在前头
研究人员对一千一百多万个新冠病毒序列进行了全面研究,结果表明 SARS-CoV-2 刺突蛋白(S蛋白)不是随机进化的,其进化路径有三种:高细胞感染性+低免疫逃逸能力、低细胞感染性+高免疫逃逸能力和高细胞感染性+高免疫逃逸能力。
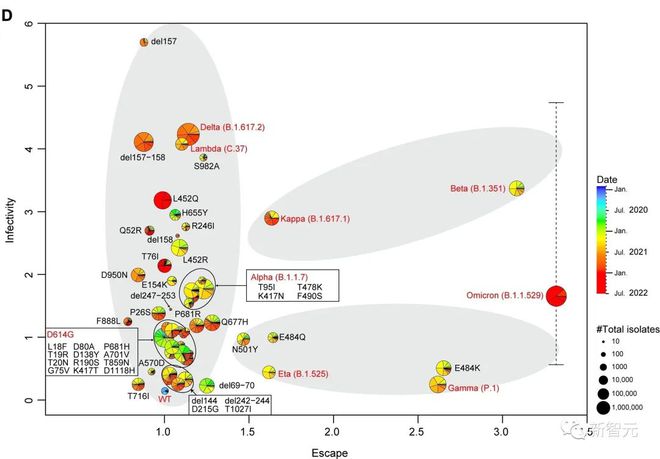
刺突蛋白进化路径
除了 Beta 和 Kappa 等有限变种外,变种的病毒感染性和免疫抗性通常是不相容的。举个例子,之前肆虐全球的奥密克戎变体具有免疫抗性最强,但仅在一种测试细胞系中表现出高感染性。
在接受澎湃新闻采访时,徐可表示,未来新冠病毒仍然更有可能朝特定方向进化。「根据现有序列数据的分析,新冠病毒更倾向于向某一个方向进化,感染性更强,或是免疫逃逸能力更强。S蛋白突变位点的功能需要协调,单个位点只能实现单功能,很难两者兼备。」
正因新冠病毒的进化路径不同,单一毒株的疫苗无法有效保护人群对抗不同进化路径上的其他变异株。
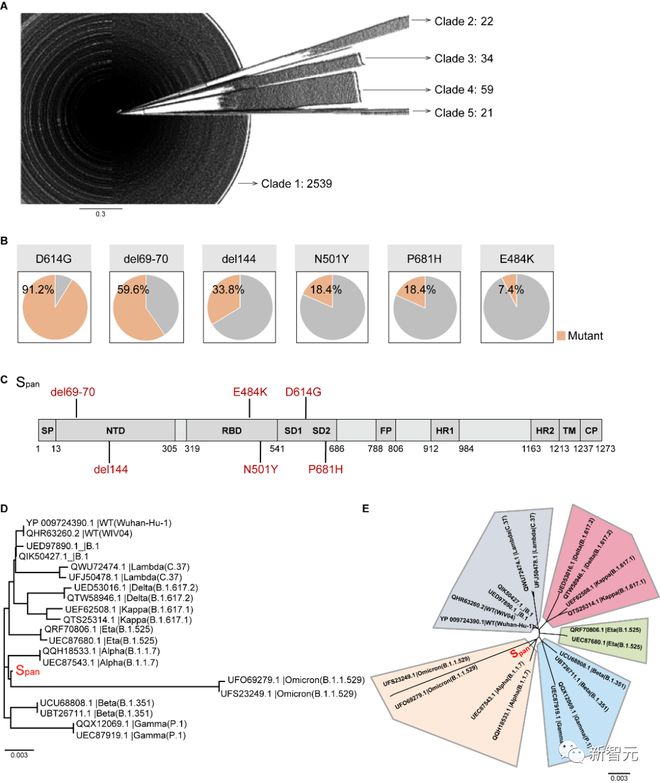
为应对新冠毒株的多种进化路径,避免进化毒株发生抗原漂移和突变,武大团队采取全新的设计策略,完成广谱疫苗免疫原 Span 的序列设计。
研究人员分析 NCBI 数据库中 2675 个蛋白序列的同源性,进而设计 Span 免疫原。研究团队计算分析得出共性突变位点,反映了序列进化中交叉进化枝的普遍性。
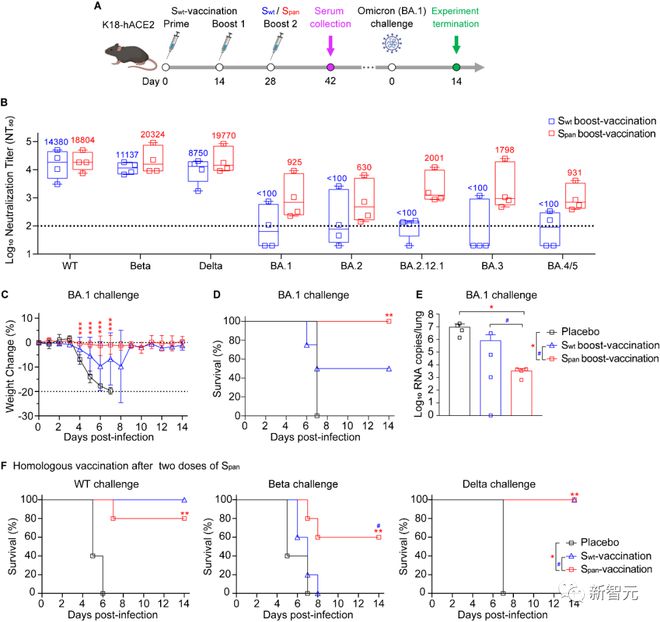
小鼠实验证明,接种过 Span 疫苗加强针的小鼠对奥密克戎变体的致命感染具有完全保护。进一步证明了广谱疫苗对抗新冠病毒抗原漂移的重要性和可行性。
通过聚类算法,武大团队筛选出五个不同进化枝的最常见突变,即 D614G、del69-70、del144、N501Y 和 P681H。并完成 Span 蛋白抗原对高频突变点位的全覆盖。
纳入高频突变点位后,Span 疫苗可以使接种人群免受高传染性变种(如 Delta 和 Lambda 变种)的危害。相比之下,高免疫逃逸变体(如 E484K)被 Span 完全覆盖。
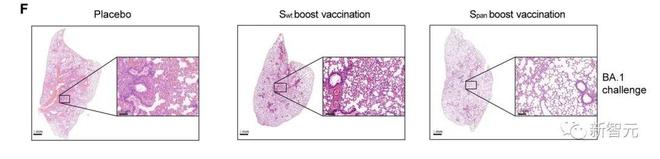
结果表明,Span 抗原可以引发对异质变异性变异的广泛体液免疫,包括 WT、Beta 和 Delta 变体。
Span 抗原不仅提高了对覆盖突变的保护,还可以提高针对未覆盖突变的中和活性。相较于 Swt 疫苗,Span 疫苗对所有 10 种变体表现出更广泛的中和活性。
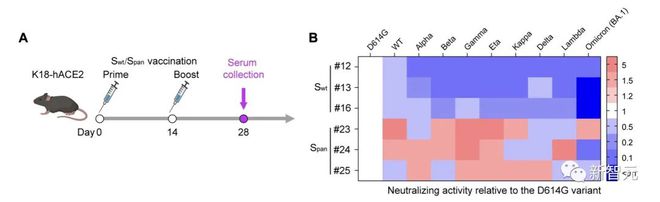
迄今为止,针对 SARS-CoV-2 的基于各种平台的广谱抗原正在开发中。然而,大多数抗原基于来自循环变体的嵌合序列,这些序列不能涵盖所有变体,也不能预测未来的变体。
在武大团队的策略中,Span 抗原是通过基于 SARS-CoV-2 刺突蛋白的进化历史计算共有序列而获得的。这种独特的策略使 Span 免疫原能够实现广谱活性,以中和各种循环毒株,以及对未来变体的逃逸能力。

研究表明,同源或异源原型加强疫苗接种或免疫调节剂佐剂可以提高针对变体的整体中和活性。然而,迫切需要设计为对任何当前变体以及未来的变体更具抵抗力的抗原。
简单来说,武大科研人员点研究表明,无论新冠病毒在人群中发生了怎样的变异,都来自同一个进化根源,而且在序列上具有相似性。因此,理想的广谱疫苗抗原应该采用大多数变体的共有位点,以促进对这些变体和其他变体的广泛中和。
人造抗原,瞄准毒株「没变」的部分
这项研究的目的就是为了解决新冠病毒不同变异株之间难以交叉免疫,且现有基于早期毒株设计的疫苗对新变异株防护力降低的问题。
新冠病毒为什么凶猛?一个重要原因就是病毒不断的变异,难以交叉免疫的原因也就在于此。
羊了一回,免疫系统产生了抗体,但是这个抗体只是针对感染的毒株,换一种新毒株,免疫系统就很难认出来了。
很多新冠变病毒异株的突刺蛋白相对初期流行的毒株,变异点位已经多达十几个甚至几十个。而人体的免疫系统构建屏障和抗体的核心就是病毒突刺蛋白的氨基酸结构。
由于毒株变异太快,免疫系统的计划赶不上变化,往往导致好不容易合成的抗体的效力大大减弱。
对这个问题,来自武汉大学的研究人员换了一种思路。
病毒变异再快,变的部分总是少数,不变的部分总是多数。能不能结合之前的数据,参考那些「没变」的部分,造一个「人造抗原」出来,然后教免疫系统认得这个抗原。
按照这个思路,造出来的人造抗原代表了大批变异病毒的共同特征。说白了,有点「 万变不离其宗」的意思,以后就不怕认不出来了。
然后再通过这个「人造抗原」进行动物实验,争取让动物的免疫系统产生能对绝大多数变异毒株都有效的抗体。
研究人员通过数据比对,下载了截至 2021 年 2 月 NCBI 数据库中所有新冠病毒序列,去重后获得 2675 条序列,通过进化聚类算法,计算分析得出共性突变位点和进化规律,设计出了人造抗原 Span。
论文作者之一徐可表示:「可以说,它是新冠病毒毒株中最有代表性、最普适的一条序列。就像一个家庭里有数个兄弟姐妹,我们找出他们的共同特征并集中到了一起。」
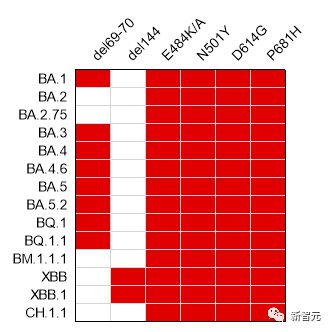
武大团队发现的 6 个共性突变位点在 Omicron 流行株(纵向标记)中均有很大程度的保留(红色表示该位点保留)。
Span 抗原的 6 个共性突变位点在奥密克戎流行株中均有很大程度的保留,最近备受关注的新毒株 BQ.1、BQ.1.1 和 XBB、XBB.1,包括在美国强势崛起的 XBB.1.5,也都和 Span 抗原共享 5 个共性突变位点。
研究显示,Span 抗原序列恰好位于新冠病毒S蛋白系统发育树的中心位置,而且和奥密克戎聚类到一起。
研究人员表示,用 Span 人造抗原序列研发的疫苗,有别于传统的单序列疫苗,从本质上提升了抗原的广谱性。未来,研究人员还会持续追踪病毒在真实世界的变异。采用这种方式做出的广谱疫苗,比过去我们追着病毒跑已经好了很多,走到了病毒的前面。
未来,我们或许五年或十年打一针广谱疫苗就够了。
参考资料:
https://www.thepaper.cn/newsDetail_forward_21450985






